Tiempo de lectura aprox: 5 minutos, 3 segundos

El tratamiento de una inyección con la proteína conocida como factor de crecimiento fibroblastos 1 (fibroblast growth factor 1, FGF1) revierte los síntomas de la diabetes tipo 2 en ratones, sin efectos secundarios por más de dos días.
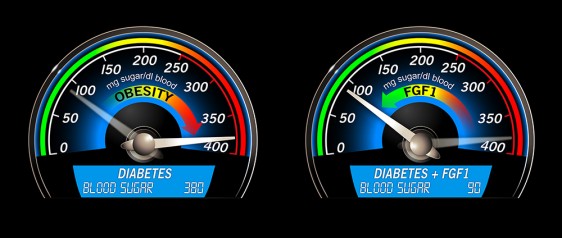
En los ratones con diabetes inducida por la dieta, es decir el equivalente de la diabetes tipo 2 en los seres humanos, una sola inyección de la proteína FGF1 es suficiente para restablecer los niveles de azúcar en la sangre a un nivel saludable durante más de dos días. El descubrimiento realizado por científicos de Salk, publicado hoy en la revista Nature, podría conducir a una nueva generación de medicamentos más eficaces y seguros para la diabetes.
El equipo encontró que el tratamiento continuo con la proteína no se limita a mantener el azúcar en la sangre bajo control, sino que también revierte la insensibilidad a la insulina, la causa fisiológica subyacente de la diabetes. Igualmente emocionante, el tratamiento de nuevo desarrollo no da lugar a efectos secundarios comunes a la mayoría de los tratamientos para la diabetes actuales.
«El control de la glucosa es un problema dominante en nuestra sociedad«, dice Ronald M. Evans, director del Salk’s Gene Expression Laboratory (Laboratorio de Expresión Genética de Salk) y el autor de enlace del artículo. «ademas la FGF1 ofrece un nuevo método para controlar la glucosa de una manera poderosa e inesperada«.
La diabetes tipo 2, que puede ser provocada por el exceso de peso y la inactividad, y en todo el mundo se ha disparado el número de los casos en las últimas décadas. Una enfermedad, donde la glucosa se acumula en el torrente sanguíneo porque no se produce suficiente insulina o porque las células se han vuelto resistentes a la insulina, haciendo caso omiso de las señales de absorber el azúcar. Al ser una enfermedad crónica, la diabetes puede causar problemas graves de salud y no tiene una cura específica. Más bien se mantiene bajo control -con diferentes niveles de éxito- a través de una combinación de dieta, ejercicio y medicamentos.
En el año 2012, Evans y sus colegas descubrieron que un factor de crecimiento de que ha sido ignorado tenía una función oculta: ayuda al cuerpo a responder a la insulina. Inesperadamente, los ratones que carecen del factor de crecimiento, llamado FGF1, desarrollan rápidamente diabetes cuando tienen una dieta alta en grasas, un hallazgo que sugiere que FGF1 jugó un papel clave en la gestión de los niveles de glucosa en sangre. Esto llevó a los investigadores a preguntarse si el proveer FGF1 extra para ratones diabéticos podría afectar a los síntomas de la enfermedad.
Equipo de Evans inyecto dosis de FGF1 en ratones obesos con diabetes para evaluar el impacto potencial de la proteína en el metabolismo. Los investigadores se sorprendieron por lo que sucedió: encontraron que con una sola dosis, los niveles de azúcar en la sangre se redujeron rápidamente a los niveles normales en todos los ratones diabéticos.
«Muchos estudios anteriores que inyectan FGF1 no mostraron efecto alguno en ratones sanos,» dice Michael Downes, un miembro del personal científico senior y co-autor correspondiente de la nueva investigación. «Sin embargo, cuando se inyecta en un ratón diabético, vimos una mejora dramática en la glucosa«.
Los investigadores encontraron que el tratamiento FGF1 tenía un número de ventajas sobre el medicamento para la diabetes Actos, que se asocia con efectos secundarios que van desde el aumento de peso no deseado a peligrosas problemas del corazón y del hígado. Es importante destacar que FGF1 -incluso a altas dosis no desencadena estos efectos secundarios o hacer que los niveles de glucosa caigan a niveles peligrosamente bajos, un factor de riesgo asociado con muchos agentes reductores de la glucosa. En cambio, las inyecciones restauran la misma capacidad del cuerpo para regular de forma natural los niveles de insulina y azúcar en la sangre, manteniendo las cantidades de glucosa dentro de un rango seguro revirtiendo en forma efectiva los síntomas principales de la diabetes.
El mecanismo de la proteina FGF1 todavía no se comprende totalmente, ni el mecanismo de resistencia a la insulina, pero el grupo de Evans descubrió que la capacidad de la proteína para estimular el crecimiento es independiente de su efecto sobre la glucosa, con lo que la proteína de paso más para su uso terapéutico.
«Hay muchas preguntas que surgen de este trabajo y las rutas para la investigación de la proteina FGF1 en la diabetes y el metabolismo se encuentran ahora abiertas de par en par«, dice Evans. Indicando las vías de señalización y los receptores que la FGF1 interactúa es una de las primeras preguntas que le gustaría abordar. Él también planea ensayos humanos de FGF1 con colaboradores, pero se necesitará tiempo para poner a punto la proteína en un fármaco terapéutico.
«Queremos trasladar esto a la gente mediante el desarrollo de una nueva generación de variantes de FGF1 que afectan exclusivamente la glucosa y no el crecimiento celular«, dice. «Si podemos encontrar la variante perfecta, creo que vamos a tener en nuestras manos una nueva herramienta, muy eficaz para el control de la glucosa«.
Otros investigadores en el estudio fueron Maryam Ahmadian, Eiji Yoshihara, Weiwei Ventilador, Yun-Qiang Yin, Ruth T. Yu, y Annette R. Atkins, del Instituto Salk para Estudios Biológicos; Weilin Liu, Johan W. Jonker, Theo van Dijk, y Rick Havinga de la Universidad de Groningen; Christopher Liddle de la Universidad de Sydney; Denise Lackey, Olivia Osborn, y Jerrold M. Olefsky de la Universidad de California en San Diego; y Regina Goetz, Zhifeng Huang, y Moisés Mohammadi de la Escuela de la Universidad de Nueva York de la Medicina.
Ronald Evans es investigador del Instituto Médico Howard Hughes y también es apoyado por becas de los Institutos Nacionales de Salud, el de Leona M. y Harry B. Helmsley Charitable Trust, la Fundación Glenn de Investigaciones Médicas, Ipsen / Biomeasure, CIRM, y Ellison Fundación Médica. Otros autores del estudio recibieron subvenciones de los Institutos Nacionales de Salud, la Salud y medicina Consejo Nacional Australiano de Investigación, el Consejo Europeo de Investigación, la Human Frontier Science Program, la Organización Holandesa para la Investigación Científica y la Fundación Holandesa Digestivo.
Referencias
- Jae Myoung Suh, Johan W. Jonker, Maryam Ahmadian, Regina Goetz, Denise Lackey, Olivia Osborn, Zhifeng Huang, Weilin Liu, Eiji Yoshihara, Theo H. van Dijk, Rick Havinga, Weiwei Fan, Yun-Qiang Yin, Ruth T. Yu, Christopher Liddle, Annette R. Atkins, Jerrold M. Olefsky, Moosa Mohammadi, Michael Downes y Ronald M. Evans Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer Nature (2014) doi:10.1038/nature13540 http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13540.html
- Jonker, J. W. et al. A PPAR?–FGF1 axis is required for adaptive adipose remodelling and metabolic homeostasis. Nature 485, 391–394 (2012) doi:10.1038/nature10998 http://www.nature.com/nature/journal/v485/n7398/full/nature10998.html



