Tiempo de lectura aprox: 2 minutos, 23 segundos
[media-credit id=1 align=»aligncenter» width=»562″] [/media-credit]
[/media-credit]
Los científicos de Cold Spring Harbor Laboratory (CSHL) reportan un descubrimiento que esperan permita el desarrollo de una nueva y poderosa forma de tratar a una forma agresiva del cáncer de mama.
El subtipo de cáncer de mama en cuestión se conoce comúnmente como «HER2 positivo«; es un subconjunto de la enfermedad que afecta a alrededor de un paciente de cada cuatro, en el que las células tumorales «sobreexpresan» una proteína de señalización llamada HER2. La droga Herceptin es un tratamiento de elección para muchas mujeres con cáncer de mama HER2-positivo, pero en la mayoría de los casos, se desarrolla una resistencia al tratamiento después de varios años. El pronóstico para los pacientes con cáncer de mama HER2-positivo es peor que la de quienes padecen otros subtipos de la enfermedad.
En un artículo que apareció el 20 de mayo en línea en la publicación Nature Chemical Biology, un equipo multi-instituciónal dirigida por CSHL Profesor Nicholas Tonks informa de que ha encontrado un medio para inhibir otra proteína, llamada PTP1B, cuya expresión también se aumentada en el cáncer de mama HER2-positivo. Se ha demostrado que la proteína PTP1B desempeña un papel crítico en el desarrollo de tumores en los que la señalización de HER2 es «aberrante».
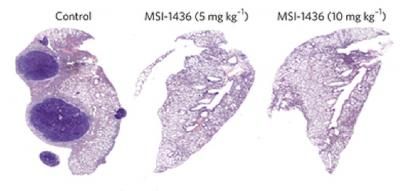
«El resultado fue una extensa inhibición del crecimiento del tumor y la prevención de la metástasis al pulmón en modelos animales HER2-positivo de cáncer de mama«, señala Navasona Krishnan, Ph.D., investigador postdoctoral en el laboratorio de Tonks quien realizó muchos de los experimentos y es el autor principal del artículo que informa de los resultados.
Dr. Tonks descubrió la proteína PTP1B hace unos 25 años. Es una enzima – uno en un «superfamilia» de 105 de las llamadas proteína tirosina fosfatasas (PTP) – que realizan la tarea bioquímica esencial de eliminación de grupos fosfato a partir de aminoácidos denominados tirosinas en otras proteínas. Agregando y eliminando grupos fosfato es uno de los medios por los cuales las señales se envían entre las proteínas.
PTP1B durante muchos años ha sido un objetivo de estudio entre los desarrolladores de drogas. Es bien conocido por ser un regulador negativo de la insulina – un antagonista de la señalización de la insulina – y de la señalización por la leptina, la hormona que ayuda a regular el apetito. Los medicamentos que pueden bloquear o inhibir la acción de PTP1B tienen un gran potencial en el control de la diabetes y la obesidad. Sin embargo, las propiedades de la molécula – que involucra su sitio de unión activo y forma – han obstaculizado los desarrolladores potenciales de fármacos inhibidores.
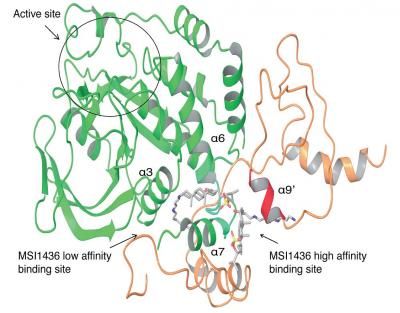
La investigación de Tonks y colaboradores revela un sitio importante de unión alternativo, llamado un sitio alostérico, que no presenta las dificultades bioquímicas que el sitio de unión activo, o «catalizador«, tiene. Este sitio alostérico es el objetivo del fármaco candidato trodusquemine.
A finales de este año comenzarán los ensayos en humanos en fase inicial para el medicamento, una colaboración de CSHL y Hospital del Norte Shore-Long Island Jewish . Dr. Tonks y CSHL tienen intereses en una empresa conjunta llamada DepYmed Inc., en asociación con Or Pharmaceutical (NasdaqCM: OHRP). La empresa busca desarrollar trodusquemine y análogos relacionados.
Referencias
- Navasona Krishnan, Dorothy Koveal, Daniel H Miller, Bin Xue, Sai Dipikaa Akshinthala, Jaka Kragelj, Malene Ringkjøbing Jensen, Carla-Maria Gauss, Rebecca Page, Martin Blackledge, Senthil K Muthuswamy, Wolfgang Peti & Nicholas K Tonks Targeting the disordered C terminus of PTP1B with an allosteric inhibitor Nature Chemical Biology (2014) doi:10.1038/nchembio.1528 http://www.nature.com/nchembio/journal/vaop/ncurrent/full/nchembio.1528.html



